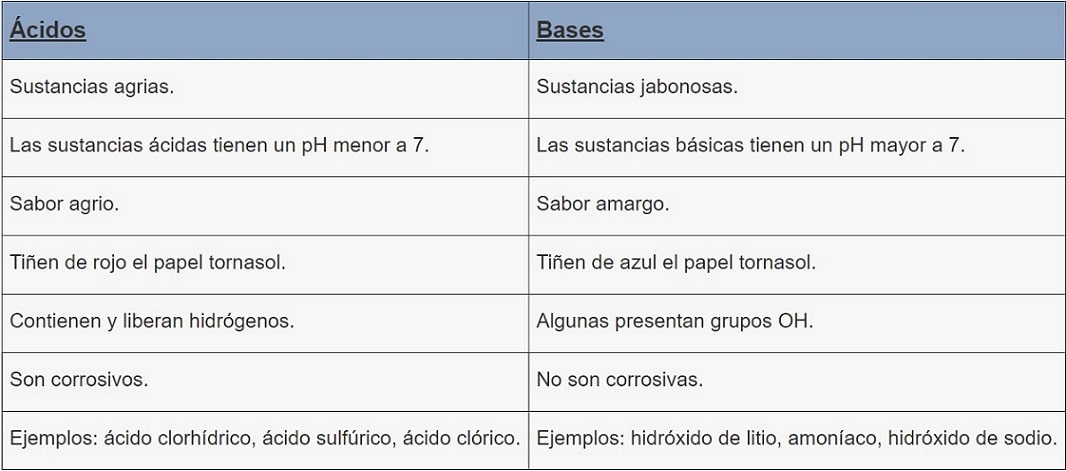
Base 1 Ácido 2 acido 1 Base 2 Un compuesto de gran importancia con propiedades anfóteras es el agua que puede actuar Como ácido H 2 O NH 3 OHPero no es un ácido o una base Algunas sales pueden ser ácidas o básicas, pero el NaCl no lo es Respuesta 3 NaCl no es ni una base, es una sal Tiene un ion positivo Na y un ion negativo Cl No es un ácido, ya que no contiene iones H como su ion positivo y no es base porque no contiene iones OH como su ión negativoEl ion nitrato es una base débil, pues proviene de un ácido fuerte y no sufre hidrólisis, El ion amonio es un ácido fuerte, pues su base conjugada es el amoniaco, que es una base débil ;por tanto, sufre hidrólisis NH 4 H 2O===== H 3O NH3 Por tanto, la disolución es ácida 5
3 6 2 Fortaleza De Acidos Quimica General
Hi is acid or base
Hi is acid or base-Un ejemplo de esto es la formación del ácido clorhídrico Cl2 H2 2HClb) Al reaccionar un oxido acido con agua se forma un oxácido Un ejemplo de esto es la formación de ácido sulfúrico SO3 H2O H2SO4 11 PROPIEDADES Tienen sabor agrio Afectan el color de los indicadoresTienen lugar en una extensión despreciable, ya que el ión Cl − es una base muy débil (su ácido conjugado es muy fuerte) y el catión Na(H 2 O) n es un ácido muy débil En consecuencia, el pH de la disolución no se modifica por las reacciones anteriores y es el mismo que el del agua pura, es decir, 7, a 25ºC




Medidor De Acido Citrico Malico Y Tartarico Y Ph En Zumos De Frutas Hi 02 Tienda On Line
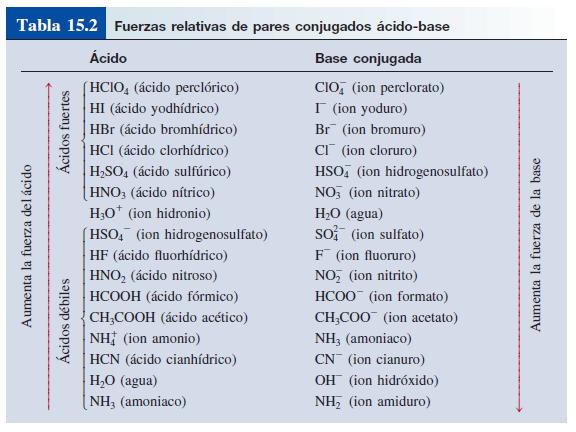
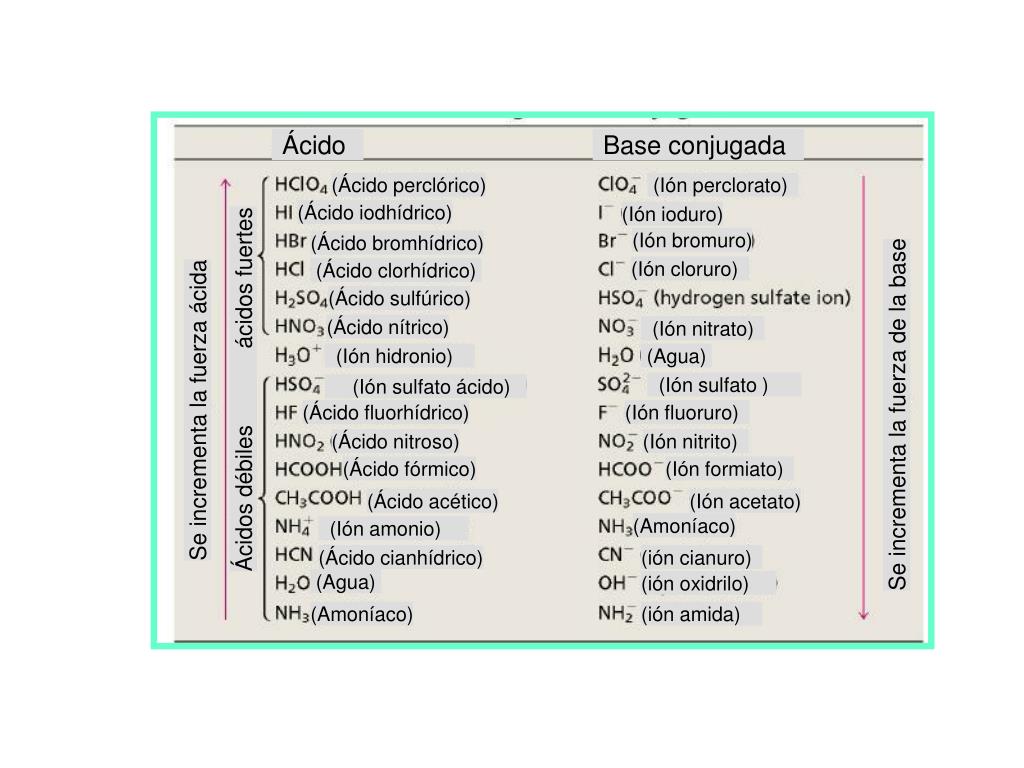
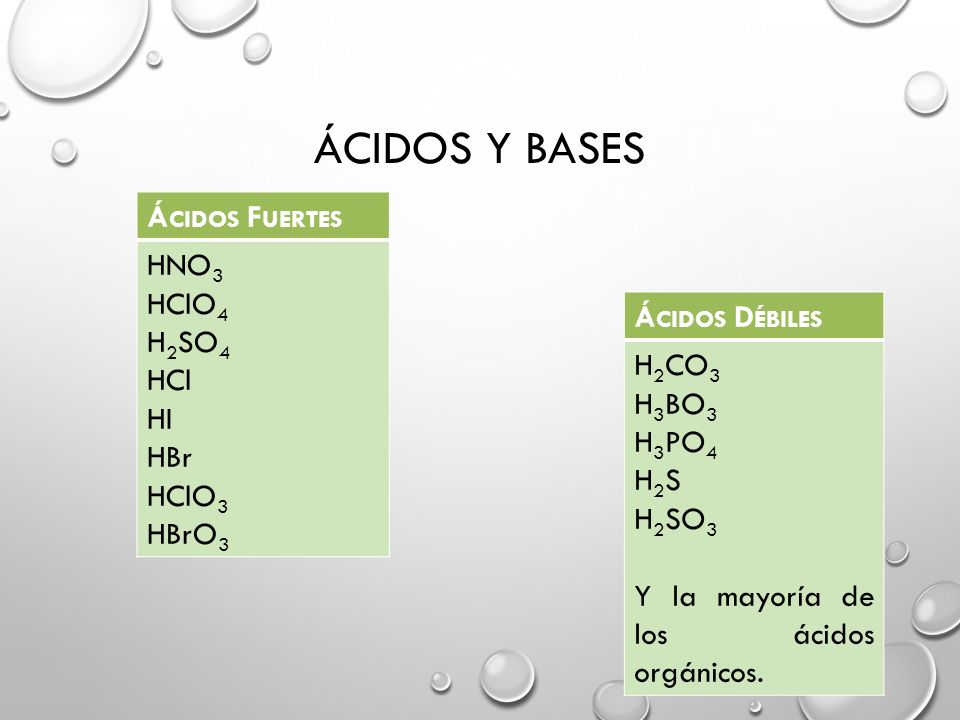
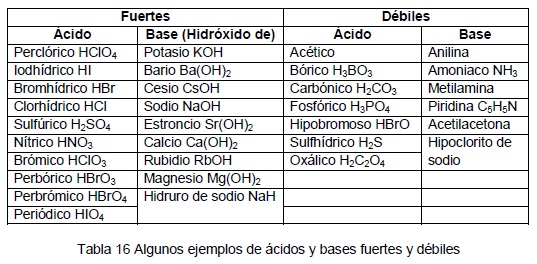
Encuentra una respuesta a tu pregunta HClO4 es acido o base mayorganelson mayorganelson Química Secundaria contestada HClO4 es acido o base 2 Hay que indicar que sólo hay seis ácidos fuertes en disolución acuosa HCl, HBr, HI, HClO4, HNO3 y H2SO4 en su primera disociación, el resto son ácidos débilesO, es decir, el ión HCO 3 actúa como ácido Asimismo, el HCl proporciona H a la disolución HCl (ac) –H – Cl por lo que HCO 3 H H 2 CO 3 (CO 2 H 2 O), es decir, el ión HCO 3– actúa como base Fuerza de ácidos En disoluciones acuosas diluidas (H 2 O constante) la fuerza de un ácido HA depende de la constante de• Hay una relación entre estructura molecular y acidez HI HBr HCl HF Longitud de enlace 160 > 141 > 127 > 91 7917 pm
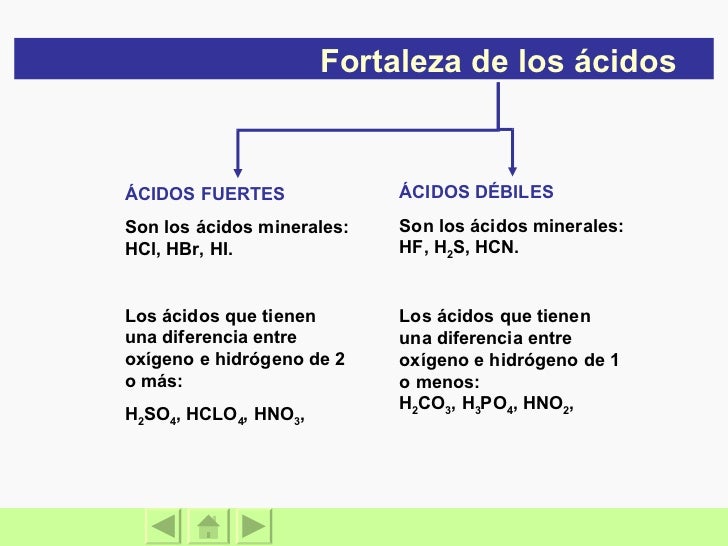
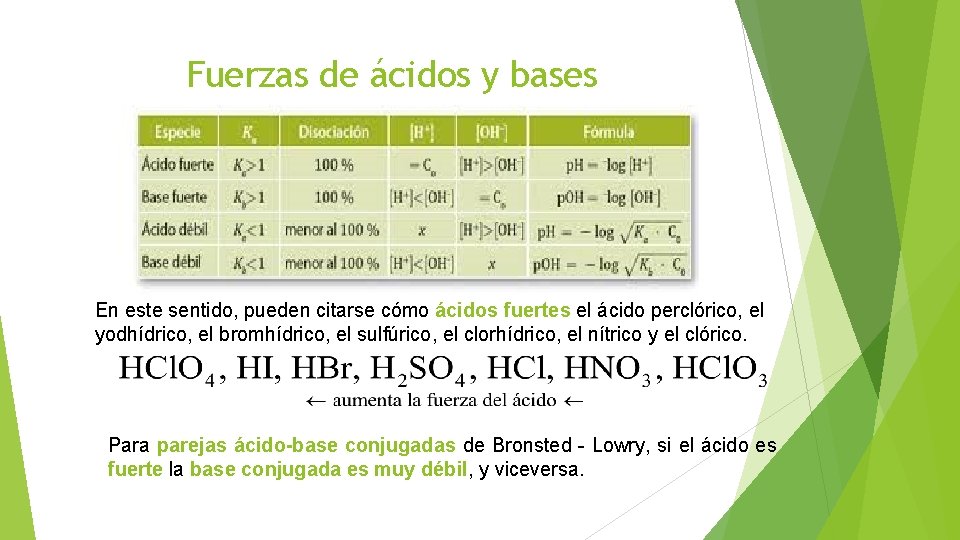
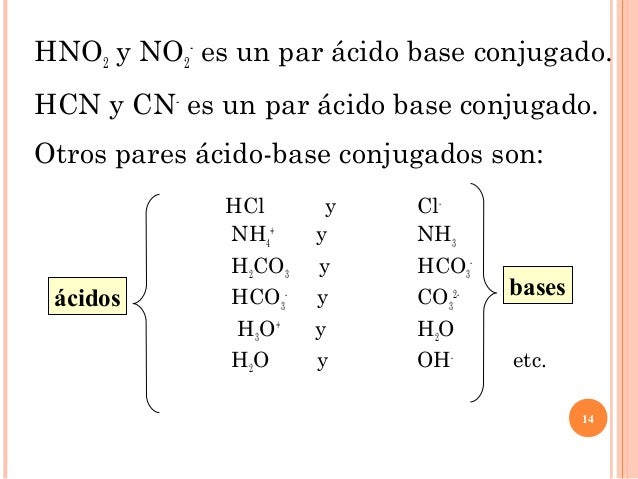
Una clasificación de los ácidos y bases en química depende de la fuerza de ionización de estas sustancias en medio acuoso Así un ácido y una base son fuertes cuando se ionizan completamente, es decir, en el proceso de ionización se transforman completamente en cationes o iones positivos y en aniones o iones negativos;Act 5Indicaa) Las bases conjugadas de los ácidos HBr, H2S y HSO4b) Los ácidos conjugados de las bases HCO3, OH y CO32 12 Act 6Identifica el carácter ácido o básico de cada una de lassiguientes especies químicas en su reacción con elagua, Escribe las reacciones a) CH – COO b) Br c) HCN d) H2AsO4 13HF > HCl > HBr > HI en cuanto a los oxoácidos, a medida que tienen más número de oxígenos, la unión XO es más fuerte y la unión OH es más débil, por lo que aumenta la fuerza del ácido, ya que el hidrógeno se puede desprender con mayor facilidad 2
– b) El ión OH es la base conjugada del H O 3 c) Sí, en una reacción química se transfieren protones, es una reacción ácidobase 15 ObservemosAcido es toda sustancia capaz de aceptar y compartir un par de electrones aportados por una baseBase es toda sustancia capaz de ceder y compartir un par de electrones con un ácido En ambos casos se forma un enlace covalente coordinado o dativo Los ácidos de Lewis tienen un orbital vacío y las Sustancia que al disolverse se ioniza con gran facilidad en iones hidronio H 3 O , su base conjugada es débil pH entre 13 Ejemplos H 2 SO 4 (ácido sulfúrico), HNO 3 (ácido nítrico) Ácido débil Sustancia que no se ioniza con gran facilidad en iones hidronio, su base conjugada es fuerte pH entre 46 Ejemplos H 2 CO 3 (ácido



2




Pcp Acidos Y Bases Pdf Docer Com Ar
• ¿Por qué CH3CO2H es un ácido más fuerte CH3CH2OH?9 rows •Base –Una sustancia que es capaz de aceptar protones (H) "Es mejor decir que dos sustanciasEn éste caso, es el OH, por lo tanto, es una base Ejercicios Ahora, para probar tus conocimientos, debes disociar las siguientes moléculas, y determinar si son ácidos, o bases 3 HS 4 KOH 5 HSO4 6 Cu(OH) 2 7 C 6 H 5 OH 8 HgOH
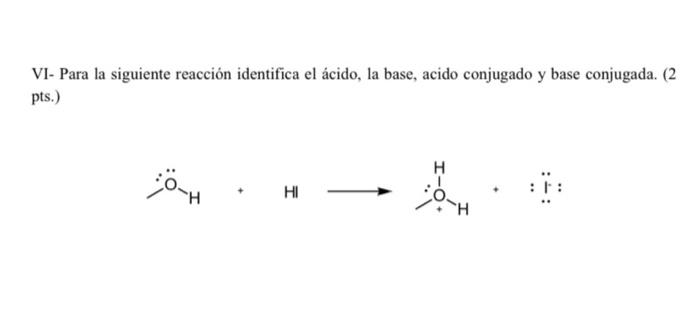



Solved Vi Para La Siguiente Reaccion Identifica El Acido Chegg Com




Laboratorio N 3 Soluciones Acido Base Y Buffer Profesora Maribel
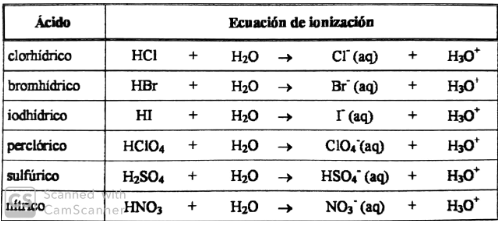
Equipo 1 Acidos y Bases 5 TEORÍA DE ARRHENIUS (ACIDO / BASE) Acidoeslasustanciaquetienehidrogenoensucomposiciónen soluciónacuosaquealdisociarseformasioneshidrógeno(H)se presentaencualquierelementocompuesto Base es un compuesto que un solución acuosa al es ácido o base 2 Ver respuestas Es hacido Sip Publicidad Publicidad alvarezjakin6 alvarezjakin6 Respuesta acido Explicación El yoduro de hidrógeno, de fórmula HI, es una molécula diatómica En condiciones estándar es un gas incoloro La disolución acuosa de yoduro de hidrógeno se conoce como ácido yodhídrico, y es un ácido fuerte Encuentra una respuesta a tu pregunta HCI es un acido o base Respuesta El ácido clorhídrico, ácido muriático, espíritu de sal, ácido marino, ácido de sal, ácido hidroclórico (traducción del inglés hydrochloric acid), o todavía ocasionalmente llamado agua fuerte o salfumán (en España), es una disolución acuosa del gas cloruro de hidrógeno (HCl)



Acidos Y Bases Ing Roque Castillo Quimica General Qq Pdf Descargar Libre



Ppt Acidos Y Bases Powerpoint Presentation Free Download Id
El catión procedente de la ionización de una base es un ácido (ácido conjugado) A la reacción del catión con agua se le llama hidrólisis ácida del catión NH3(aq) H2O(l) NH4(aq) OH–(aq) NH4(aq) H2O(l) NH3(aq) H3O(aq) Es fácil comprender que "cuanto más fuerte es un ácido más débil es su base conjugada" Las bases oO izquierda El HCl es un ácido fuerte en agua porque transfiere fácilmente un protón al agua formando un ion hidronio (H3O ) HCl H2O → H 3O ClÁcido(1) Base(2) Ácido(2) Base(1) Á fuerte B débil Afuerte B débil Vemos así que, cuanto más fuerte es el ácido frente a otra especie química, más débil es su base conjugada3 H2O acido base Å F G CalvoFlores Diapositiva 4 de 38Tema 9 Ácidos y bases • ¿Por qué HCl es un ácido fuerte, y HF es débil?




Examenes De Quimica De Selectividad Acido Base Ph Selectividad Quimica Selectividad Quimica




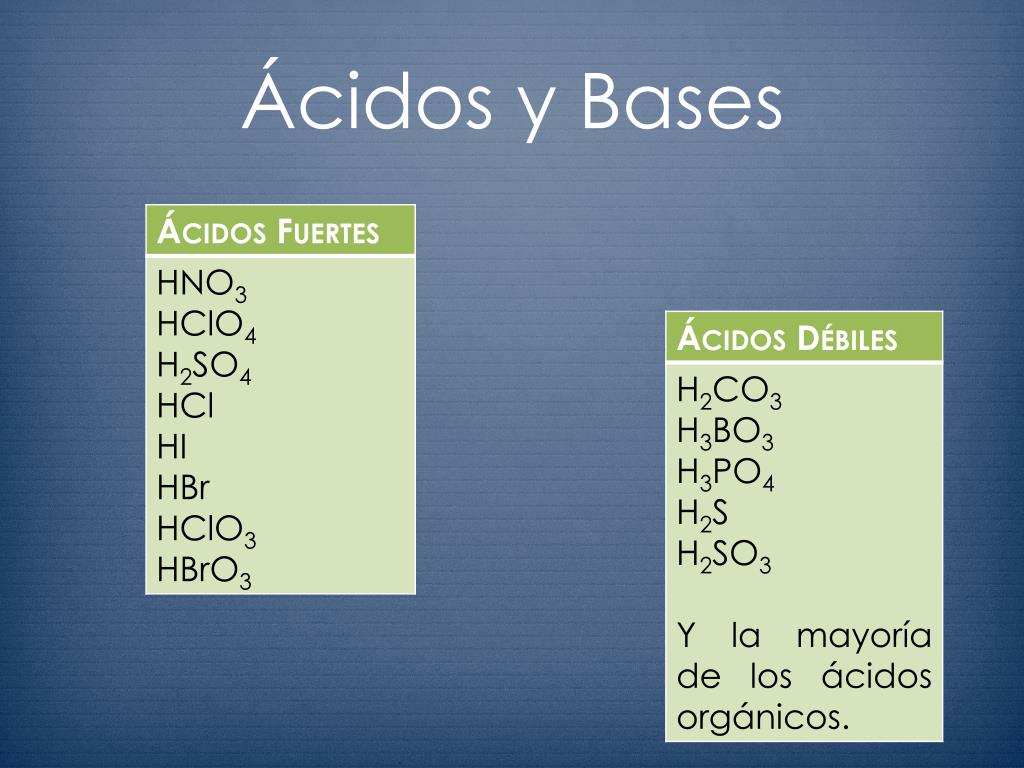
Problemas De Avises Y Determinacion De Ph Docsity
HCIO > HI > HBr > HNO3 > HCI > H^SO, i/v^w^VPara apoyar todavía más su razonamiento, estudia los espectros de absorción en la región ultravioleta y obsei"va que el ácido nítrico con centrado presenta un especti"o distinto que el diluido;Ácido / base Tipo Fórmula Ácido acético Ácido débil CH 3 COOH Ácido fórmico Ácido débil HCOOH El ácido fluorhídrico Ácido débil HF Sulfuro de hidrógeno Ácido débil H 2 S El ácido nítrico Acido fuerte HNO 3 Ácido clorhídrico Acido fuerte HCl Ácido yodhídrico Acido fuerte Hl De ácido perclórico Acido fuerte HClO 4 Amoniaco Débil base NH 3 piridina Débil base2O ↔ NH 3 H 3O Acido Base Base Conjugada Acido Conjugado En muchos casos, el concepto de ácido o de base para una sustancia es relativo, dependiendo de la sustancia con que reaccione Las sustancias que pueden actuar unas veces como ácidos y otras como base, se llaman anfóteras o anfipróticas Como por ejemplo el agua HCl H



1




Acido Wikipedia La Enciclopedia Libre
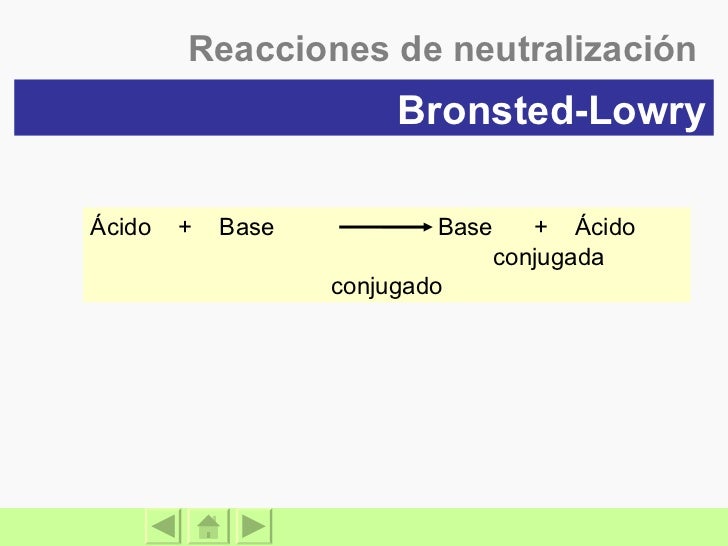
EjemploEjemplo 151a 151a Identifique los ácidos y base BrønstedLowry, y sus pares conjugados, en la reacción H2SO4 H2O HSO4– H3O ácido base base ácido conjugada conjugado H H H2SO4 HSO4 pierdepierde H H, 2SO4 es el ácido HSO4 su base conjugada H2O H3O, aceptaacepta un H H 2O es la base H3O su ácido conjugadoTabla con algunos pares conjugados ácido/base en orden decreciente de acidez (ka) Para determinar ka es necesaria una sustancia de referencia, que en este caso es el agua Ácido H 2 O H 3 O Base conjugadaEs el agua Una base de Brønsted tiene un par solitario de electrones al cual puede unirse el protón Por ejemplo, un ión óxido es una base de Brønsted Cuando el CaO se disuelve en agua, el campo eléctrico fuerte del pequeño ión O2–, extremadamente cargado, remueve un protón de una molécula de H 2 O vecina (Fig 113)




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh



2
Ahora, para determinar si es una base o un ácido, basta con mirar el ion por el que está disociado;O HI →H I H 2 O Li 2 CO 3 →2 Li 3 2 H 2 O HCN →H CN H 2 O Mg(OH) 2 →Mg2 2 OH El equilibrio de disociación de la base es C 6 H 5 NH 2 H 2 O ←→C 6 H 5 NH 3 OH Se cumple que K b 4,2 10 10 0,0 x 5 x x, y la solución es x 4,6 10 6 M Esta será la concentración de OH Las definiciones de Lewis de ácidos y bases En 1923, GN Lewis sugirió otra forma de ver la reacción entre los iones H y OH En el modelo de Brnsted, el ion OH es la especie activa en esta reacción acepta un ion H para formar un enlace covalente En el modelo de Lewis, el ion H es la especie activa que acepta un par de electrones del ion OH para formar un enlace



Acido Yodhidrico Hi Estructura Propiedades Y Usos




Factores Que Influyen En La Acidez
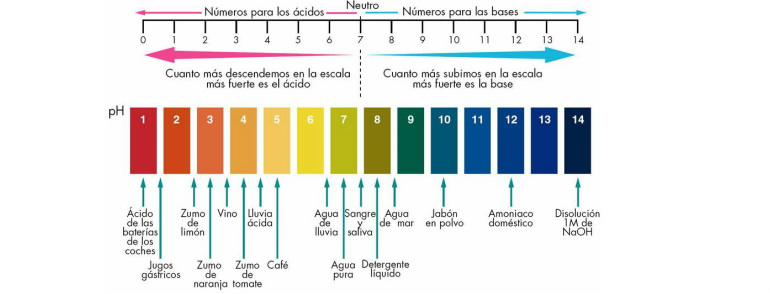
Por otro lado, un ácido y una base son16 rows La fuerza de un ácido o una base se determina por el grado de disociación del compuesto en agua•Por ello, ningún ácid o más fuerte que el agua permanecerá sin ionizarse en H 2O •Por ejemplo, no es posible discernir si el HBr es más o menos fuerte que el HI, epues ambos se disocian totalmente en agua •Se dice, entonces, que el H 2O tiene un efecto nivelador que iguala la acidez de todos los ácidos más fuertes que el H 3O



Acidos Y Bases Diferencias Caracteristicas Ejemplos




Ayuda Lo Nesesito Urgente 2 Disocia Cada Una De Las Siguientes Especies Acido Base Aplicando La Brainly Lat
Esta es una reacción ácidobase (neutralización) Explicación Ba(OH)2 es una base, H2SO4 es un ácidoPor otra parte, el espectro de absorción del nítrico concentrado es análogo al de los esEs considerado una base según BrønstedLowry En la reacción inversa El NH 4 cede un H para formar NH 3, y por consiguiente, actúa como ácido de BL El amonio es el acido conjugado de la base amoniaco El hidróxido acepta un H formando H 2 O, por lo tanto, es una base BL El hidróxido es la base conjugada del agua NH 3




Acido Wikipedia La Enciclopedia Libre




Acidos Y Bases Capitulo Ppt Descargar
Los ácidos que tienen una diferencia entre oxígeno e hidrógeno de 1 o menos H 2 CO 3 , H 3 PO 4 , HNO 2 , 21 Fortaleza de las bases BASES FUERTES Son las bases de la familia IA y algunas de la familia II excepto la de berilio NaOH, KOH, LiOH, Ca (OH) 2 BASES DÉBILES Be (OH) 2 , NH 3 22



2



2




Quimica2 By Colegio De Bachilleres Del Estado De Sonora Sonora Issuu




Acido Base Acidos Y Bases De Arrhenius Youtube




Fuerza De Acidos Y Bases Ppt Descargar



2



1



Acidos Y Bases



2



Equilibrio Acido Base Acidos Y Bases O Bjetivos 1 Identificar Compuestos Acidos Y Basicos De Acuerdo A Las Teorias Mas Importantes 2 Relacionar Ppt Descargar




Tabla Con Algunos Pares Conjugados Acido Tabla Con Algunos Pares Conjugados En Orden Decreciente Studocu




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh




Tema 12 Acidos Y Bases Teoria Youtube



Acidos Y Bases



Exapuni Curso Online Quimica 05 Teoria Acidos Bases




Equilibrio Acido Base Ii Principal Ppt Powerpoint



2



Fuerza De Acidos Y Bases Quimica




Resumen Equilibrio Acido Base Misuperclase Com



Reacciones De Transferencia Cidobase Profesora Roxana Reinoso Caro



2




Definiciones Acido Base Video Khan Academy




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas



1 O Contenido O Propiedades Generales De Acido Y Base O Teorias De Acidos Y Bases O Fuerza Relativa De Acidos Y Bases O



3 6 2 Fortaleza De Acidos Quimica General
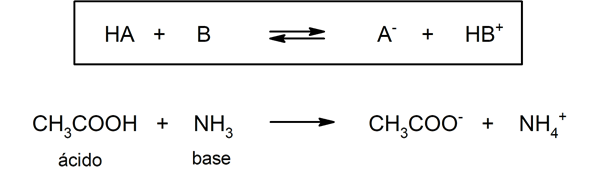



Como Se Forman Los Acidos Bases Y Sales




Atomo Neutralizacion Acido Base




Suero Serico Antienvejecimiento A Base De Platino Y Acido Hialuronico



1




Chimie General Couple Acido Basique Flashcards Quizlet



Ppt Equilibrio Acido Base Powerpoint Presentation Free Download Id




Tema 6 Acidos Y Bases Pdf Descargar Libre




Calameo Tabla Con Algunos Pares Conjugados Acido



Classifique Em Base Ou Acido Ordenar Por Grupo




Semana 12 Cidos Bases Y Electrolitos Qumica 19




Acidos Y Bases Ppt Descargar



2




Acido Y Bases Ejercicios Resueltos Pdf Segun Arrhenius Bronsted Lowry Lewis Ph Y Poh




Informe De Cuestionario Seminario 6 Pdf Acido Electrolito




Ejer Resueltos2 Catedu




Leccin 3 Equilibrios En Disolucin Y Valoraciones I
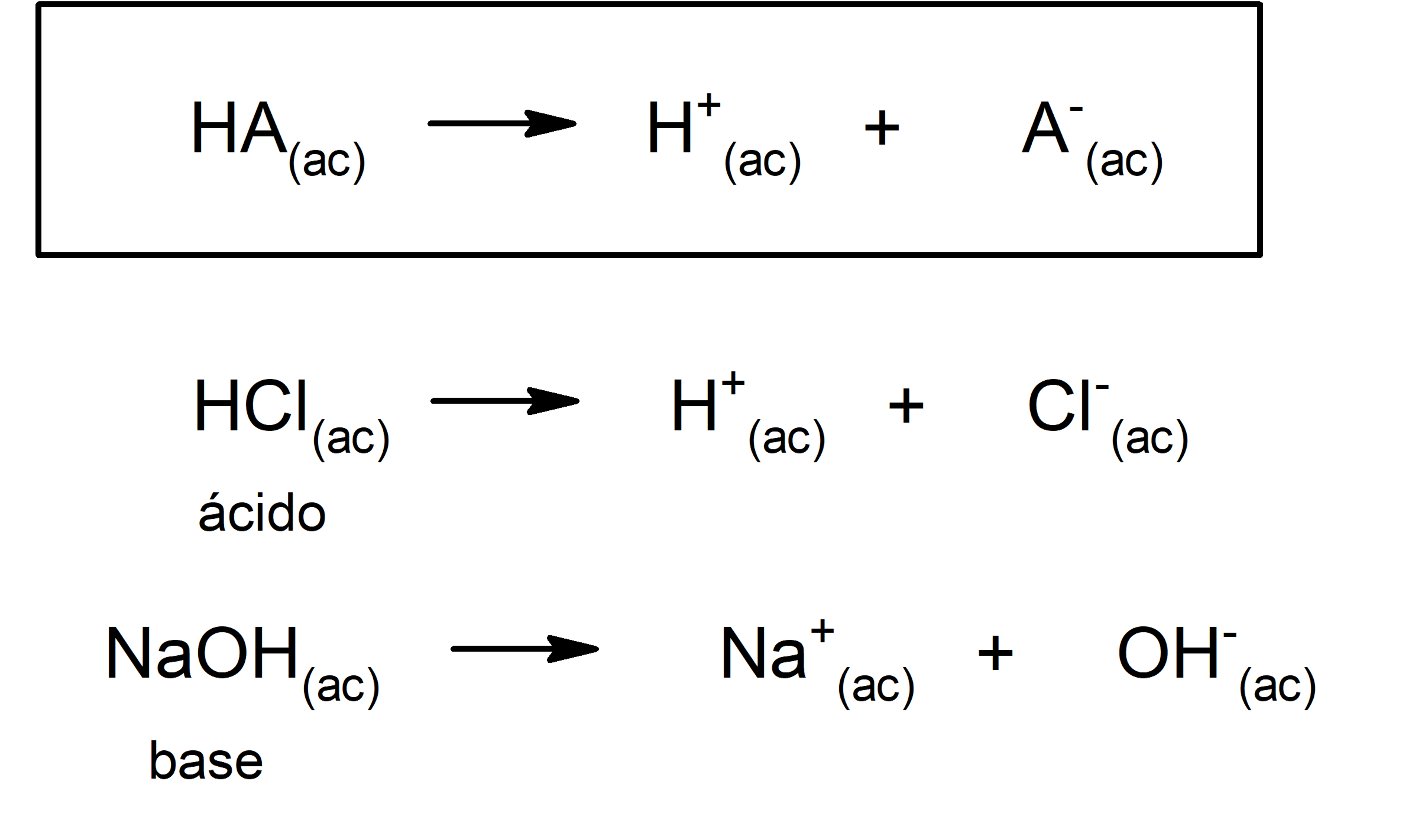



Como Se Forman Los Acidos Bases Y Sales




Resumen De Quimica Chang Quimica General Ingenieria Civil Utn Filadd



1



Mapa Conceptual De Acido Mapa Mental




Que Son Los Buffers Oxigeno Soluciones Quimicas Apuntes Universitarios Udocz




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas




Acidos Y Bases Pdf Txt



2



2



Identificar Materiales Usando Un Indicador Acido Base




Acidos Y Base Oxido Reduccion Acidos Apuntes Universitarios Udocz




Teor Shy A Cido Base



2



2



2




Ejercicios Resueltos Anaya Acidos Y Bases Docsity



Aicido Base Quimica Basica




Acidos Y Bases Practico Pdf Ph Acido




16 E Equilibrios Acido Base Ejercicios La Fisica Y Quimica




Acidos Y Bases Fuertes Calculo Ph Los Acidos Y Bases Fuertes Son Sustancias De Interes En La Vida Cotidiana Y En La Industria Por Ejemplo El Acido Sulfurico Es Esencial En La Industria De Fertilizantes En La Produccion De Acero O En El Sector



Equilibrio Acido Base




Admision Uni 10 2 Tema P Pregunta 01 Youtube




Ejercicio De Acidos Y Bases




Medidor De Acido Citrico Malico Y Tartarico Y Ph En Zumos De Frutas Hi 02 Tienda On Line



2




Acidos Y Bases




Fuerza De Acidos Y Bases Ppt Descargar




Acidos Y Bases




Definicion Acido Base Pdf Acido Fisica Molecular




Fisica Quimica Ejercicios Resueltos Acidos Y Bases Bronsted Lowry



2




Calculo De Ph Pdf Ph Acido



2
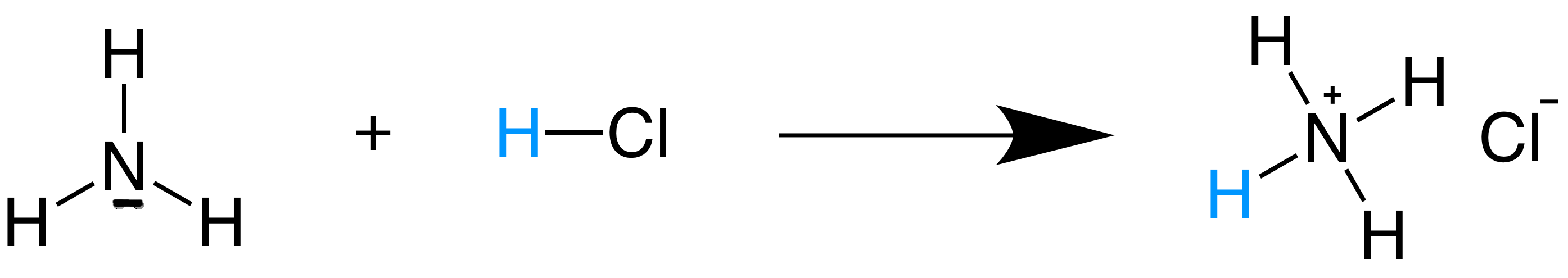



Definitions De Bronsted Lowry Des Acides Et Des Bases Lecon Khan Academy




Arrhenius Bronsted Lowry Lewis Ppt Descargar



2




Ejercicio De Clasificacion Acidos Y Bases




Acidos Y Bases Bronsted Lowry Bronsted Lowry En 1923 El Danes Johannes Nicolaus Bronsted Y El Ingles Thomas Lowry Introdujeron Una Nueva Teoria Acerca De Los Acidos Y Las Bases Que Mejoraba La Anterior De Arrhenius Resolviendo Algunas



Ionizacion De Acidos Y Bases




Ppt Reacciones De Transferencia De Protones Acido Base 2 Bach Powerpoint Presentation Id




4 1 4 Guia Ejercicios Acido Base By Ricardo Riquelme Issuu



Bases Fuertes Y Debiles Apuntes De Bioquimica Docsity




Solved Vi Para La Siguiente Reaccion Identifica El Acido Chegg Com




Acido Base



2



0 件のコメント:
コメントを投稿